Perkembangan terapi gen dalam satu dekade terakhir sangat dipengaruhi oleh kemajuan metode rekombinasi DNA poten yang mampu memodifikasi materi genetik secara sangat presisi. Dari teknik klasik rekombinasi homolog hingga teknologi pengeditan genom modern seperti CRISPR, ZFN, dan TALEN, seluruh pendekatan ini bergerak menuju satu tujuan besar, yaitu mengoreksi penyakit pada sumbernya, di tingkat DNA. Bagi dunia kedokteran, metode rekombinasi DNA poten bukan lagi sekadar konsep laboratorium, melainkan fondasi dari generasi baru pengobatan yang menargetkan penyebab biologis penyakit dengan tingkat ketepatan yang belum pernah ada sebelumnya.
Mengapa Metode Rekombinasi DNA Poten Menjadi Pusat Perhatian Dunia Medis
Metode rekombinasi DNA poten telah mengubah cara ilmuwan dan klinisi memandang penyakit genetik dan sejumlah penyakit kronis lain. Dahulu, terapi hanya berfokus pada gejala, menekan keluhan pasien tanpa menyentuh akar penyebab di dalam sel. Kini, dengan kemampuan untuk “mengedit” genom, kita mulai memasuki era di mana koreksi langsung pada DNA pasien menjadi opsi yang realistis.
Pusat perhatian ini muncul karena beberapa alasan utama. Pertama, beban penyakit genetik di dunia sangat besar, mulai dari talasemia, hemofilia, distrofi otot Duchenne, hingga berbagai bentuk kebutaan herediter. Kedua, terapi konvensional untuk penyakit kronis seperti diabetes, kanker, dan penyakit autoimun sering kali hanya mengendalikan penyakit, tidak menyembuhkan. Ketiga, perkembangan teknologi sekuensing genom, bioinformatika, dan biologi molekuler membuat rekayasa genetik menjadi jauh lebih aman dan terukur dibanding era 1980 dan 1990an.
“Jika obat konvensional ibarat memadamkan api di permukaan, maka terapi gen berbasis metode rekombinasi DNA poten adalah upaya mematikan sumber percikan api di dalam kabel listrik yang tersembunyi.”
Dasar Ilmiah Rekombinasi DNA dan Evolusi Menuju Teknik Poten
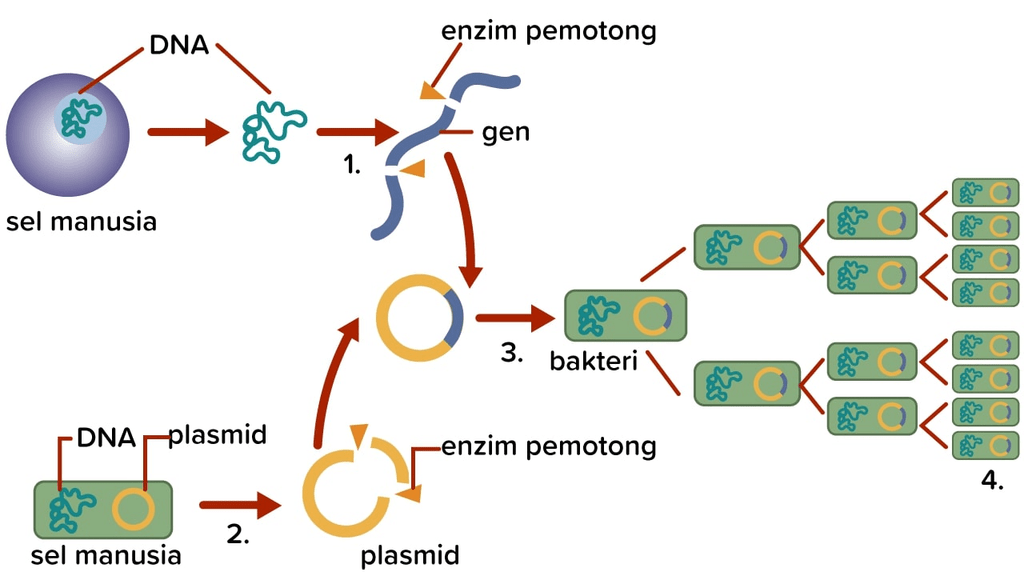
Sebelum membahas bagaimana metode rekombinasi DNA poten digunakan dalam terapi gen, penting untuk memahami dasar biologinya. Rekombinasi DNA adalah proses pertukaran segmen materi genetik antara dua molekul DNA. Di alam, proses ini terjadi secara fisiologis saat meiosis, ketika kromosom homolog bertukar bagian untuk menghasilkan keragaman genetik.
Pada tingkat sel, ada dua mekanisme perbaikan DNA yang menjadi pintu masuk bagi teknologi rekombinasi:
1. Perbaikan melalui rekombinasi homolog, yang menggunakan sekuens DNA “template” sebagai panduan untuk memperbaiki kerusakan.
2. Perbaikan sambung ujung non homolog, yang lebih cepat namun kurang presisi, sering kali menyebabkan penyisipan atau penghapusan kecil pada DNA.
Ilmuwan kemudian memanfaatkan kedua jalur ini. Dengan menciptakan patahan terarah pada lokasi tertentu di genom dan menyediakan DNA donor sebagai template, sel “dipaksa” memperbaiki diri menggunakan materi genetik baru tersebut. Dari sinilah lahir konsep metode rekombinasi DNA poten, yaitu penggunaan alat molekuler yang sengaja dirancang untuk mengarahkan rekombinasi ke titik yang diinginkan dengan efisiensi tinggi.
Evolusi Teknologi: Dari Rekombinasi Homolog Klasik ke Pengeditan Genom Presisi
Perjalanan menuju metode rekombinasi DNA poten yang kita kenal sekarang tidak terjadi dalam semalam. Di awal, peneliti mengandalkan rekombinasi homolog alami dengan memasukkan fragmen DNA donor ke dalam sel dan berharap fragmen tersebut terintegrasi di lokasi yang tepat. Efisiensinya rendah dan sulit dikendalikan.
Kemudian, muncul gagasan menggunakan enzim pemotong DNA yang spesifik lokasi. Dengan memotong DNA di tempat tertentu, sel “dipaksa” mengaktifkan mekanisme perbaikan, sehingga peluang integrasi DNA donor di titik itu meningkat drastis. Di sinilah lahir generasi pertama teknologi pengeditan genom:
1. Zinc Finger Nucleases ZFN
ZFN adalah protein rekayasa yang menggabungkan domain pengikat DNA yang disebut zinc finger dengan domain pemotong DNA FokI. Setiap zinc finger mengenali tiga basa DNA tertentu. Dengan merangkai beberapa zinc finger, ilmuwan dapat memprogram ZFN untuk mengenali urutan DNA spesifik. Ketika dua ZFN berikatan di sisi berseberangan dari DNA, domain FokI bergabung dan memotong DNA, menciptakan patahan untai ganda.
2. Transcription Activator Like Effector Nucleases TALEN
TALEN bekerja dengan prinsip serupa, tetapi domain pengikat DNAnya berasal dari protein TALE bakteri tanaman. Setiap modul TALE mengenali satu basa, sehingga desainnya lebih fleksibel dibanding zinc finger. TALEN terbukti lebih mudah dirancang dan lebih spesifik, meski ukurannya besar dan agak menyulitkan pengantaran ke sel.
3. CRISPR Cas Systems
CRISPR Cas, terutama CRISPR Cas9, merevolusi semua yang ada sebelumnya. Berbeda dari ZFN dan TALEN yang bergantung pada protein pengikat DNA kompleks, CRISPR menggunakan RNA pemandu pendek yang komplementer dengan target DNA. Cas9 adalah enzim pemotong, sementara RNA pemandu memberitahu ke mana Cas9 harus pergi. Sistem ini jauh lebih sederhana, murah, dan mudah diprogram ulang, sehingga mempercepat penelitian secara dramatis.
Ketiga generasi teknologi ini, meski berbeda, memiliki tujuan yang sama: menciptakan patahan DNA terarah yang kemudian dimanfaatkan sebagai titik masuk metode rekombinasi DNA poten untuk memasukkan atau memperbaiki gen.
Metode Rekombinasi DNA Poten dalam Terapi Gen: Prinsip Kerja di Dalam Sel
Dalam konteks terapi gen, metode rekombinasi DNA poten tidak berdiri sendiri. Ia adalah bagian dari rangkaian proses yang meliputi pemilihan target gen, desain alat pengeditan, pengantaran ke sel, dan pengawasan hasil. Prinsip kerjanya dapat diringkas dalam beberapa tahap kunci.
Pertama, penentuan target gen dan mutasi. Dokter dan peneliti mengidentifikasi gen yang bermutasi dan bertanggung jawab terhadap penyakit. Misalnya, gen HBB pada talasemia beta, atau gen RPE65 pada bentuk tertentu kebutaan herediter.
Kedua, desain sistem pemotong DNA. Di sinilah metode rekombinasi DNA poten mulai berperan. Peneliti memilih apakah akan menggunakan CRISPR Cas, TALEN, atau pendekatan lain, lalu merancang urutan pemandu atau modul pengikat DNA yang spesifik.
Ketiga, penyediaan DNA donor. Untuk memperbaiki mutasi, fragmen DNA donor yang mengandung sekuens gen yang benar disiapkan. Fragmen ini mengandung bagian yang identik dengan DNA pasien di sekitar situs pemotongan, sehingga sel mengenalinya sebagai template saat memperbaiki patahan.
Keempat, pengantaran ke sel target. Sistem ini harus masuk ke dalam sel yang relevan, misalnya sel punca hematopoietik untuk penyakit darah, atau sel retina untuk penyakit mata. Pengantaran dapat menggunakan vektor virus seperti AAV atau lentivirus, atau metode non virus seperti nanopartikel lipid dan elektroporasi.
Kelima, rekombinasi dan perbaikan. Setelah masuk ke inti sel, alat pemotong DNA menciptakan patahan di lokasi target. Sel mengaktifkan mekanisme perbaikan. Bila DNA donor tersedia dan kondisi mendukung, sel menggunakan rekombinasi homolog untuk memperbaiki patahan dengan memasukkan urutan DNA yang benar. Inilah inti metode rekombinasi DNA poten dalam terapi gen: mengarahkan perbaikan DNA ke jalur yang menguntungkan pasien.
Varian Teknik: Knock in, Knock out, dan Koreksi Presisi
Metode rekombinasi DNA poten dalam terapi gen dapat diarahkan untuk beberapa tujuan berbeda, tergantung kebutuhan klinis. Tiga pendekatan yang paling banyak digunakan adalah knock in, knock out, dan koreksi presisi.
Knock in gen terapeutik
Pada pendekatan ini, gen baru yang memiliki fungsi terapeutik dimasukkan ke lokasi tertentu di genom. Misalnya, memasukkan gen yang mengkode reseptor chimeric antigen receptor CAR ke dalam sel T pasien untuk terapi kanker. Rekombinasi DNA diarahkan ke “lokus aman” safe harbor seperti AAVS1, sehingga gen baru dapat diekspresikan stabil tanpa mengganggu gen penting lain.
Knock out gen penyebab penyakit
Beberapa penyakit tidak memerlukan penambahan gen baru, melainkan penghilangan aktivitas gen yang merugikan. Contoh klasik adalah mematikan gen CCR5 di sel T untuk melindungi dari infeksi HIV, meniru mutasi alami CCR5 delta32 yang memberi resistensi terhadap HIV pada sebagian kecil populasi. Dengan metode rekombinasi DNA poten, dibuat patahan DNA di dalam gen tersebut sehingga perbaikan melalui jalur non homolog menghasilkan mutasi inaktif.
Koreksi presisi mutasi tunggal
Inilah bentuk terapi yang paling dekat dengan konsep “memperbaiki kesalahan ketik di dalam buku petunjuk tubuh”. Pada penyakit seperti anemia sel sabit, satu perubahan basa tunggal pada gen HBB menyebabkan konsekuensi klinis berat. Dengan metode rekombinasi DNA poten, mutasi ini dapat dikoreksi kembali ke urutan normal. Pendekatan ini sangat menuntut presisi tinggi dan pengendalian efek di luar target.
Metode Rekombinasi DNA Poten dalam Terapi Gen Hematologi
Bidang hematologi menjadi salah satu ladang uji utama metode rekombinasi DNA poten karena sel darah relatif mudah diambil, dimanipulasi, dan dikembalikan ke tubuh pasien. Beberapa penyakit darah yang menjadi fokus utama adalah talasemia beta dan anemia sel sabit.
Pada talasemia beta, produksi hemoglobin beta terganggu akibat mutasi pada gen HBB. Salah satu strategi adalah menggunakan metode rekombinasi DNA poten untuk mengaktifkan kembali ekspresi hemoglobin janin HbF dengan menargetkan regulator seperti BCL11A. Dengan mengurangi aktivitas BCL11A melalui pengeditan genom, ekspresi HbF meningkat dan sebagian mengkompensasi kekurangan hemoglobin dewasa.
Pada anemia sel sabit, mutasi tunggal menyebabkan hemoglobin menggumpal saat kadar oksigen rendah, memicu krisis nyeri dan kerusakan organ. Pendekatan terapi gen berbasis rekombinasi DNA dapat mengoreksi mutasi tersebut secara langsung atau, serupa dengan talasemia, mengaktifkan kembali HbF untuk mengurangi pembentukan hemoglobin abnormal.
Prosedurnya umumnya dilakukan secara eks vivo. Sel punca hematopoietik diambil dari sumsum tulang pasien, dimodifikasi di laboratorium menggunakan metode rekombinasi DNA poten, kemudian dikembalikan setelah pasien menjalani kondisioning kemoterapi untuk membuka ruang di sumsum tulang. Hasil uji klinis awal menunjukkan perbaikan signifikan, dengan banyak pasien bebas transfusi atau jauh berkurang kebutuhan transfusinya.
Rekombinasi DNA Poten untuk Terapi Penyakit Mata dan Saraf
Organ seperti mata dan sistem saraf pusat selama ini dianggap sulit ditangani dengan terapi gen karena keterbatasan regenerasi sel dan hambatan pengantaran ke jaringan tersebut. Namun, metode rekombinasi DNA poten mulai mengubah pandangan ini.
Pada penyakit mata, terutama retina, beberapa terapi gen telah disetujui regulator dengan pendekatan yang mendekati rekombinasi terarah. Pada bentuk kebutaan herediter terkait mutasi RPE65, misalnya, gen fungsional disisipkan ke retina menggunakan vektor virus. Meski tidak selalu menggunakan rekombinasi homolog klasik, prinsip penggantian fungsi gen yang rusak tetap menjadi inti pendekatan ini.
Di bidang neurologi, fokus awal banyak tertuju pada penyakit neurodegeneratif seperti penyakit Huntington dan beberapa bentuk ataksia spinocerebellar yang disebabkan oleh ekspansi ulangan DNA. Metode rekombinasi DNA poten memberikan peluang untuk mengurangi ekspresi gen toksik atau memperbaiki sekuens yang bermasalah. Tantangan terbesarnya adalah pengantaran alat pengeditan ke neuron di seluruh otak secara aman dan merata.
“Pada penyakit saraf, kita seperti mencoba memperbaiki kabel listrik di gedung yang sudah tua tanpa mematikan semua lampu. Metode rekombinasi DNA poten memberi kita alat, tetapi cara menggunakannya dengan aman masih menjadi pekerjaan besar.”
Rekombinasi DNA Poten dalam Onkologi: Dari Terapi CAR T hingga Pengeditan In Vivo
Onkologi adalah bidang lain yang sangat diuntungkan dari metode rekombinasi DNA poten. Terapi CAR T adalah contoh paling menonjol. Dalam terapi ini, sel T pasien diambil, kemudian dimodifikasi di laboratorium agar mengekspresikan reseptor chimera yang mengenali antigen spesifik di permukaan sel kanker, seperti CD19 pada leukemia limfoblastik akut.
Awalnya, integrasi gen CAR ke genom sel T dilakukan secara acak menggunakan vektor virus. Namun, dengan berkembangnya metode rekombinasi DNA poten, peneliti mulai mengarahkan integrasi ke lokus aman atau bahkan memodifikasi beberapa gen sekaligus. Misalnya, mematikan reseptor tertentu pada sel T untuk mengurangi risiko reaksi imun berlebihan, atau menghapus molekul yang menghambat aktivitas sel T di lingkungan tumor.
Selain CAR T, upaya pengeditan langsung sel tumor di dalam tubuh in vivo juga mulai dieksplorasi. Pendekatan ini lebih kompleks karena harus menargetkan sel kanker secara selektif tanpa merusak sel sehat. Rekombinasi DNA diarahkan untuk mematikan onkogen, mengaktifkan gen penekan tumor, atau membuat sel kanker lebih rentan terhadap kemoterapi dan imunoterapi.
Keamanan Metode Rekombinasi DNA Poten: Isu Off Target dan Mutagenesis
Sehebat apa pun potensinya, metode rekombinasi DNA poten tetap membawa risiko yang tidak boleh diabaikan. Dua isu utama adalah efek di luar target off target dan potensi mutagenesis yang tidak diinginkan.
Efek off target terjadi ketika alat pemotong DNA seperti CRISPR Cas atau TALEN juga memotong di lokasi lain yang memiliki kemiripan sekuens dengan target utama. Patahan di lokasi yang tidak diinginkan ini dapat memicu mutasi, penghapusan besar, atau rearansemen kromosom yang berpotensi menyebabkan kanker atau gangguan fungsi sel.
Untuk mengurangi risiko ini, beberapa strategi dikembangkan:
1. Desain pemandu CRISPR yang sangat spesifik dengan bantuan algoritma bioinformatika.
2. Penggunaan varian Cas berpresisi tinggi yang dimodifikasi untuk mengurangi pemotongan di lokasi mirip target.
3. Penggunaan “base editor” atau “prime editor” yang mengubah basa DNA tanpa menciptakan patahan untai ganda, sehingga mengurangi aktivasi jalur perbaikan yang berisiko.
4. Pemantauan genom luas setelah pengeditan untuk mendeteksi perubahan yang tidak diinginkan sebelum sel dikembalikan ke pasien.
Mutagenesis insersi juga menjadi perhatian bila vektor virus digunakan untuk mengantarkan komponen terapi. Integrasi acak ke dekat onkogen dapat memicu transformasi sel menjadi ganas, sebagaimana pernah terjadi pada beberapa uji klinis terapi gen generasi awal. Kini, penggunaan vektor non integratif dan integrasi terarah melalui metode rekombinasi DNA poten menjadi strategi mitigasi penting.
Tantangan Pengantaran: Virus, Nanopartikel, dan Pendekatan Fisik
Salah satu hambatan terbesar dalam penerapan luas metode rekombinasi DNA poten adalah bagaimana mengantarkan sistem pengeditan ke sel target dengan efisien dan aman. Tiga kelompok pendekatan utama adalah vektor virus, sistem non virus berbasis nanopartikel, dan metode fisik.
Vektor virus seperti AAV, lentivirus, dan adenovirus memiliki keunggulan efisiensi tinggi. AAV banyak digunakan untuk terapi gen mata dan otot karena relatif aman dan bersifat non integratif. Namun, kapasitas muat DNA AAV terbatas, sehingga sulit membawa semua komponen besar seperti Cas9 dan donor DNA dalam satu paket. Lentivirus dapat mengintegrasi ke genom, cocok untuk terapi eks vivo sel punca, tetapi membawa risiko integrasi acak.
Sistem non virus, seperti nanopartikel lipid, mulai naik daun terutama setelah suksesnya vaksin mRNA. Nanopartikel dapat dikemas dengan mRNA Cas, RNA pemandu, dan donor DNA, kemudian disuntikkan ke pasien. Keuntungannya adalah tidak ada integrasi virus ke genom, tetapi efisiensi masuk ke sel target tertentu masih menjadi tantangan.
Pendekatan fisik seperti elektroporasi banyak digunakan untuk terapi eks vivo. Arus listrik singkat membuka pori membran sel sehingga DNA dan RNA dapat masuk. Metode ini efektif untuk sel darah dan sel punca, tetapi tidak praktis untuk terapi langsung di dalam tubuh.
Aspek Etik dan Regulasi dalam Penerapan Rekombinasi DNA Poten
Setiap kali teknologi kedokteran menyentuh inti identitas biologis manusia, yaitu genom, isu etik dan regulasi menjadi sangat penting. Metode rekombinasi DNA poten menghadirkan garis batas baru yang harus dijaga dengan ketat.
Perbedaan mendasar dibuat antara pengeditan sel somatik dan sel germline. Pengeditan somatik hanya mempengaruhi individu yang menerima terapi dan tidak diwariskan ke keturunannya. Sebagian besar uji klinis terapi gen saat ini berada di ranah ini dan secara etik lebih dapat diterima, terutama bila ditujukan untuk penyakit serius yang mengancam jiwa.
Sebaliknya, pengeditan sel germline seperti sel telur, sperma, atau embrio dini, akan mengubah genom keturunan dan berpotensi memengaruhi generasi berikutnya. Banyak komunitas ilmiah internasional dan lembaga etik menentang penerapan klinis pengeditan germline untuk saat ini, terutama untuk tujuan non terapeutik seperti peningkatan kemampuan fisik atau kognitif.
Regulator seperti FDA di Amerika Serikat dan EMA di Eropa menerapkan standar ketat untuk uji klinis terapi gen berbasis metode rekombinasi DNA poten. Mereka menuntut data keamanan jangka panjang, pemantauan efek off target, serta transparansi dalam pelaporan hasil baik positif maupun negatif.
Kesiapan Sistem Kesehatan dan Tantangan Akses Pasien
Meskipun kemampuan teknis metode rekombinasi DNA poten semakin matang, kesiapan sistem kesehatan untuk mengadopsinya secara luas masih jauh dari ideal. Terapi gen umumnya memerlukan fasilitas laboratorium berstandar tinggi, tenaga ahli biologi molekuler dan klinisi terlatih, serta infrastruktur pemantauan jangka panjang.
Biaya terapi juga sangat tinggi. Beberapa terapi gen yang sudah disetujui regulator dunia memiliki harga mencapai jutaan dolar per pasien. Meski biaya ini sering kali dibandingkan dengan biaya seumur hidup terapi konvensional, tetap saja menjadi penghalang besar bagi banyak negara berpenghasilan rendah dan menengah.
Selain itu, tidak semua rumah sakit dapat melakukan prosedur kompleks seperti pengambilan sel punca, manipulasi eks vivo, dan infus ulang sel yang telah dimodifikasi. Hal ini menimbulkan risiko kesenjangan akses, di mana hanya pasien di pusat rujukan besar atau negara maju yang dapat menikmati manfaat metode rekombinasi DNA poten dalam terapi gen.
Diskusi mengenai model pembiayaan inovatif, seperti pembayaran bertahap berbasis hasil outcome based payment, mulai mengemuka. Namun, penerapan konkret di lapangan masih terbatas dan memerlukan kerja sama erat antara pemerintah, industri farmasi, dan penyedia layanan kesehatan.
Peran Penelitian Dasar dan Kolaborasi Multidisiplin
Keberhasilan metode rekombinasi DNA poten dalam terapi gen tidak dapat dilepaskan dari investasi panjang dalam penelitian dasar biologi molekuler, genetika, dan mikrobiologi. Penemuan sistem CRISPR, misalnya, berawal dari studi tentang mekanisme pertahanan bakteri terhadap virus, sesuatu yang pada awalnya tampak sangat jauh dari dunia klinis.
Kini, untuk membawa metode rekombinasi DNA poten dari meja laboratorium ke ranjang pasien, diperlukan kolaborasi multidisiplin yang erat. Ahli biologi struktural membantu merancang varian enzim yang lebih spesifik. Bioinformatikus mengembangkan algoritma untuk memprediksi dan meminimalkan off target. Klinisi memberikan wawasan mengenai kebutuhan nyata pasien dan desain uji klinis yang etis. Regulator dan ahli kebijakan kesehatan menyiapkan kerangka kerja agar inovasi dapat diterapkan dengan aman dan adil.
Tanpa sinergi berbagai disiplin, metode rekombinasi DNA poten berisiko terjebak sebagai teknologi canggih yang hanya hidup di jurnal ilmiah, bukan di ruang rawat pasien yang membutuhkan.
Harapan Pasien dan Realitas Batasan Biologi
Bagi banyak pasien dengan penyakit genetik berat, metode rekombinasi DNA poten dan terapi gen membawa harapan yang sebelumnya tampak mustahil. Anak dengan kelainan darah yang dulunya diprediksi membutuhkan transfusi seumur hidup kini bisa menjalani hari hari tanpa transfusi. Pasien dengan gangguan penglihatan herediter mendapatkan kembali sebagian kemampuan melihat.
Namun, penting untuk menjaga ekspektasi tetap realistis. Tidak semua penyakit dapat diatasi dengan mudah melalui pengeditan genom. Beberapa kondisi melibatkan banyak gen sekaligus, faktor lingkungan, dan jalur biologis kompleks yang belum sepenuhnya dipahami. Selain itu, tubuh manusia memiliki sistem pertahanan dan regulasi yang dapat bereaksi tak terduga terhadap perubahan besar di tingkat DNA.
Metode rekombinasi DNA poten adalah alat yang sangat kuat, tetapi tetap tunduk pada batasan dasar biologi. Setiap keberhasilan spektakuler di satu penyakit sering kali disertai tantangan besar di penyakit lain. Keseimbangan antara optimisme ilmiah dan kehati hatian klinis menjadi kunci agar teknologi ini benar benar memberi manfaat dan tidak menimbulkan kekecewaan atau bahaya baru.